Le terme « Arboviroses » regroupe les infections causées par des virus transmis aux humains lors de piqûres de moustiques ou de morsures de tiques (vecteurs faisant partie des arthropodes).
Certaines arboviroses peuvent être acquises au Québec puisque les vecteurs en cause s’y trouvent (en milieux urbains ou en campagne). D’autres sont exclusivement acquises à l’étranger, puisque les conditions climatiques du Québec ne sont pas propices à la survie des vecteurs qui les causent. Les changements climatiques apportant des changements épidémiologiques, il est important de demeurer préoccupés par l’augmentation de l’incidence des arboviroses et par leur émergence dans des zones précédemment épargnées.
Les arboviroses pouvant être acquises au Québec et ailleurs au Canada sont l’infection au virus du Nil occidental (VNO), les infections associées aux virus du sérogroupe Californie (VSC) dont Jamestown Canyon (VJC) et Snowshoe hare (VSH) sont les plus fréquentes. Rarement rapportées, l’encéphalite de Powassan et l'encéphalite équine de l'Est (EEE) peuvent également être contractées au Québec.
Les arboviroses acquises exclusivement lors de voyages à l’extérieur du pays sont la dengue, le Chikungunya, le Zika, la fièvre jaune, le virus d’Oropouche, l’encéphalite de St-Louis et les encéphalites associées à d’autres VSC que VJC et VSH (ex. : VLAC, VEC).
Les médecins et les laboratoires doivent déclarer aux autorités de santé publique locales dans les meilleurs délais tout cas de VNO ou de VSC, avec ou sans symptômes et qu’ils soient neurologiques ou non neurologiques. En ce qui a trait aux autres arboviroses, consultez Maladies à déclaration obligatoire (MADO) Cet hyperlien s'ouvrira dans une nouvelle fenêtre. destinée aux médecins et Maladies à déclaration obligatoire (MADO Cet hyperlien s'ouvrira dans une nouvelle fenêtre.) destinée aux laboratoires.
Il est important de promouvoir les mesures de protection contre les piqûres de moustiques (mesures personnelles et environnementales), particulièrement auprès des personnes les plus vulnérables aux infections sévères (âge avancé, immunosuppression, présence de maladie chronique ou grossesses pour certaines infections par exemple).
La prévention est primordiale pour les voyageurs considérant que…
Il est donc important de…
Mesures de protection personnelles : Limiter l’exposition aux moustiques vecteurs, particulièrement aux moments des pics d’activité des moustiques, en portant des vêtements qui couvrent autant que possible votre corps, en s’appliquant des répulsifs cutanés et en utilisant des insecticides sur les vêtements. Utiliser des écrans anti-insectes (moustiquaires), idéalement imprégnés de répulsif contenant du DEET, de l’icaridine ou d’huile d’eucalyptus citronné (3e choix contre-indiqué pour certaines personnes, voir fiche descriptive).
La prévention est aussi primordiale pour tout résident du Québec considérant que…
Il demeure impossible d’établir l’épidémiologie réelle des arboviroses acquises puisque la majorité des infections à VNO et à VSC sont asymptomatiques (environ 80 %) et que, lorsque symptomatiques, les personnes atteintes éprouvent des symptômes non spécifiques n’entraînant pas nécessairement de consultation médicale. Ce que nous avons donc comme données épidémiologiques représente la pointe de l’iceberg, soit les infections graves conduisant à une consultation médicale et à la présence de symptômes suffisamment sévères pour entraîner un dépistage, ou encore des déclarations par Héma-Québec lors de dons de sang de personnes asymptomatiques.
Au Québec, la surveillance humaine du VNO a débuté en 2003. Depuis, en dehors des années 2012, 2018 et 2020 (pics de 134, 201 et 63 cas respectivement), le nombre de cas rapporté est demeuré entre 10 et 20 cas par année. En 2024, 74 cas ont été enregistrés dans la province. La saison avait commencé plus tôt qu’à l’habitude (1er cas confirmé le 11 juillet). En Chaudière-Appalaches, cinq cas ont été rapportés, ce qui est bien supérieur aux observations des 20 dernières années (un en 2012 et en 2013; deux en 2018). L’âge varie de 50 à 71 ans. Trois d’entre eux ont été hospitalisés, dont une personne admise aux soins intensifs. Tous ont acquis l’infection au Québec à travers leurs activités quotidiennes ou de loisirs.
En 2023, 20 cas avaient été rapportés au Québec de la mi-août à octobre chez des personnes âgées entre 29 et 84 ans (âge médian de 66 ans). La majorité (76 %) présentait des symptômes neurologiques et plus de la moitié avaient été hospitalisés, avec un décès rapporté chez une personne de plus de 70 ans. Pour plus d’information, consulter Statistiques VNO.
Voici les modes de transmission et les manifestations cliniques pouvant indiquer une possible infection au VNO soit pendant la période des moustiques au Québec, ou lors de retour de voyages en présence de maladies fébriles ou de maladies neuro-invasives. Il n’est pas possible de distinguer l’étiologie virale d’une arbovirose par la seule présentation clinique étant donné la présentation symptomatologique similaire.
Virus du Nil Occidental | ||||
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Vecteur présent au Québec
|
| Infections neurologiques graves dans moins de 1 % des cas infectés sous forme de : méningite,encéphalite, méningoencéphalite, myélite se manifestant généralement par des symptômes selon le site touché : fièvre, modification de l'état mental, crises d'épilepsie, déficits neurologiques focalisés, troubles du mouvement, paralysie flasque aiguë (avec progression possible vers la paralysie respiratoire nécessitant une ventilation artificielle) et paralysie ou parésie d'un membre isolé. | 2 à 14 jours |
Létalité entre 4 et 14 % pour les cas sévères (taux supérieur chez les 50 ans et plus) |
Des statistiques sont disponibles sur le VSC à partir de 2006. L’incidence varie, mais demeure faible au cours des dernières années.
Entre 2020 et 2022, on rapportait de 12 à 15 cas par année, avec une diminution à cinq cas en 2023 (dont deux probables). En 2024, 5 cas ont été déclarés, dont 3 confirmés.
En Chaudière-Appalaches, deux cas ont été retenus comme confirmés en 2021 (Jamestown canyon et Snowshoe hare) et deux cas en 2019. En 2024, un cas a été confirmé. Il aurait été acquis dans la région.
Voir le site du ministère de la Santé et des Services sociaux
Il n’est pas possible de distinguer l’étiologie virale d’une arbovirose par la seule présentation clinique étant donné la présentation symptomatologique similaire.
Virus du sérogroupe Californie | ||||
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
|
| Dans environ 1 % des cas : Infections neurologiques graves. Lorsque le système nerveux central est infecté, le virus a traversé la barrière hémato-encéphalique. Les symptômes observés reflètent l’atteinte des tissus touchés selon qu’il s’agisse de méningite, d’encéphalite ou de myélite. | 2 à 14 jours |
|
Voir le site du ministère de la Santé et des Services sociaux
Quelques cas humains d’EEE ont été déclarés au Québec en 2024. Il s’agissait historiquement des premiers cas déclarés au Québec. Par ailleurs, le MAPAQ rapporte une augmentation des cas d’encéphalite équine de l’Est (EEE) chez des chevaux en 2024.
Au total, trois cas humains ont été rapportés en Ontario au cours des dernières années (5 au total pour le Canada de 2016 à 2023). Quelques cas humains sont également rapportés annuellement aux États-Unis, soit entre un et 38 cas par an de 2003 à 2023 (moyenne annuelle de 11 avec d’importantes fluctuations).
Virus de l’encéphalite équine de l’Est | ||||
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
| Symptômes d’allure grippale :
| Infections neurologiques graves :
Taux de létalité de 25 à 75 %. | 4 à 10 jours |
|
Voir le site du ministère de la Santé et des Services sociaux
En 2023, le premier cas d’encéphalite de Powassan acquis au Québec a été déclaré. En 2024, un cas fut confirmé en Chaudière-Appalaches (possiblement contracté en Mauricie-Centre-du-Québec) avec atteintes neurologiques sévères. Le nombre de cas annuel déclaré au Canada n’a jamais dépassé 4.
Il ne s’agit pas d’un test de routine.
Consulter le répertoire du LSPQ pour détection des anticorps Powassan
Virus de Powassan | ||||
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
| Fièvre, frissons, vomissements, faiblesse généralisée | Symptômes de méningoencéphalite, symptômes méningés, état mental altéré, convulsions, aphasie, parésie, troubles du mouvement, atteintes des nerfs crâniens | 1-4 semaine(s) |
|
En plus de la plupart des infections pouvant être acquises au Québec, qui peuvent aussi être acquises lors de voyages dans d’autres pays, certaines infections transmises par des arthropodes ne peuvent être acquises que lors de voyages dans certains pays. C’est le cas du virus de la dengue, qui est en nette augmentation, du virus d’Oropouche (VORO), en émergence en Amérique du Sud et dans les Caraïbes, et des virus du Chikungunya, du Zika et de la fièvre jaune.
MADO : Déclarer rapidement à la Direction de Santé publique les cas d’arboviroses à déclaration obligatoire et tous les cas de virus Oropouche (indépendamment de leurs symptômes).
La dengue progresse de façon importante et serait l’arbovirose la plus commune mondialement. La majorité des cas proviennent de l’Amérique du Sud, plus particulièrement du Brésil, mais il s’agit d’un virus très répandu : plus de 40% de la population mondiale vivrait dans une région où la dengue peut être transmise selon l’OMS. Des cas ont par ailleurs été acquis localement aux États-Unis (Floride et Hawaii).
La dengue progresse de façon fulgurante parmi les résidents du Québec également : 500 cas ont été déclarés en 2024, 166 en 2023, 67 en 2022. En comparaison, en moyenne 7 cas par année de 2010 à 2021 inclusivement avaient été déclarés. Les résidents en Chaudière-Appalaches n’échappent pas à cette progression : on y rapporte 16 cas en 2024 et 9 en 2023, alors qu’un maximum de 2 cas annuels étaient rapportés au cours des années précédentes. Tous les cas sont associés à des voyages. Aucun décès n’a été rapporté.
Vous trouverez regroupé les modes de transmission et les manifestations cliniques pouvant nous laisser suspecter la dengue lors de retours de voyages. Ne pas oublier de considérer cette infection en présence de maladie fébrile. Il n’est pas possible de distinguer l’étiologie d’une arbovirose par la seule présentation clinique étant donné la présentation symptomatologique similaire.
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
| Début soudain de forte fièvre;
6 à 8 jours :
| Dengue hémorragique :
| 3 à 14 jours |
|
Selon l’Organisation panaméricaine de la santé (OPS), depuis le début de l’année 2024, l’incidence des infections par le virus Oropouche (VORO) a considérablement augmenté en Amérique du Sud et se propage au-delà de son aire de répartition historique (qui était surtout le bassin amazonien du Brésil) et touche désormais les Caraïbes. Une première épidémie de maladie à virus Oropouche a été déclarée à Cuba le 27 mai 2024 et plus tard en République Dominicaine. Deux québécois auraient été parmi les cas d’Oropouche en 2024, dont aucun parmi les résidents de Chaudière-Appalaches.
Le virus Oropouche est un virus émergent dans les Amériques qui se transmet aux humains par des moucherons piqueurs infectés et par certaines espèces de moustiques. Il peut également être propagé par certains moustiques, notamment les moustiques Culex quinquefasciatus, qui peuvent également propager les virus du Nil occidental et de l’encéphalite de Saint-Louis.
La maladie peut survenir chez des personnes de tout âge et est souvent confondue avec la dengue.
Possible transmission sexuelle de l'Oropouche : Un rapport scientifique récent décrit la première fois que le virus Oropouche a été détecté dans le sperme d'un patient atteint d'Oropouche, ce qui soulève des inquiétudes quant au risque éventuel de transmission sexuelle. D'autres virus (comme les virus Zika et Ebola) présents dans le sperme ont déjà été associés à une transmission sexuelle. Aucun cas de transmission sexuelle du virus Oropouche n'a été signalé jusqu’à maintenant.
La transmission verticale, soit l’infection transmise de la mère au fœtus pendant la grossesse, a été associée à des décès fœtaux, à des mortinaissances et à des malformations congénitales (OPS, 2024)(Alerte en Juillet 2024). Le risque qu’une personne enceinte infectée transmette le virus à son fœtus n’est pas actuellement connu. Hormis la transmission verticale, il n’y a pas de transmission interhumaine de l’Oropouche actuellement prouvée. Des décès ont été signalés chez des personnes atteintes d'Oropouche.
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
|
| Infections neurologiques graves (près de 5% des cas)
| 3 à 12 jours |
|
Évolution : guérison habituelle avec récurrence possible des symptômes après résolution | ||||
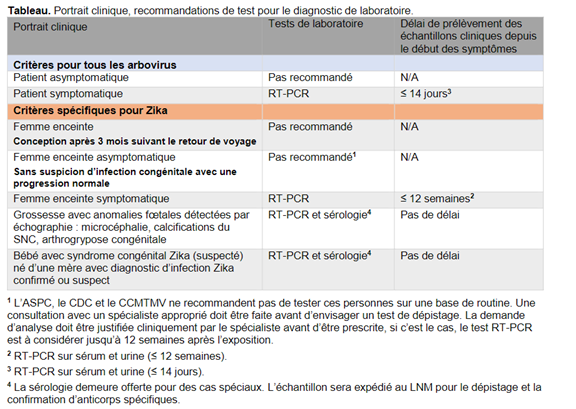
Depuis les années 1950, le virus Zika a été détecté de manière occasionnelle en Afrique et en Asie. En Amérique, le virus Zika a été identifié pour la première fois au Brésil en 2015 et s’est propagé en Amérique centrale, dans les Caraïbes et au Mexique. Aux États-Unis, en 2016, il y a eu transmission limitée, mais depuis 2018, aucun cas acquis localement n’a été rapporté dans la partie continentale des États-Unis.Le nombre de cas de maladie à virus Zika diminue depuis 2017 à l’échelle mondiale. Toutefois, de faibles niveaux de transmission vectorielle persistent dans plusieurs pays.
En février 2016, le lien de causalité entre le virus Zika et certaines malformations congénitales a été confirmé. L’Organisation mondiale de la santé (OMS) a qualifié la microcéphalie et d’autres troubles neurologiques liés à la maladie à virus Zika d’urgence de santé publique de portée internationale. L’OMS a mis fin à l’urgence de santé publique en novembre 2016.
Parmi les résidents du Québec, aucun cas n’avait été déclaré en 2024, 2 cas avaient été déclarés en 2023 et 1 en 2020. Aucun de ces cas ne résidait en Chaudière-Appalaches.
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
| Asymptomatique dans 70 à 80 % des cas. Les cas symptomatiques peuvent présenter :
| Formes sévères :
| 3 à 14 jours |
|
La maladie causée par le virus Chikungunya est à déclaration obligatoire (MADO) depuis le 17 octobre 2019. La maladie a d’abord été endémique principalement en Asie du Sud et en Afrique, avant de s’étendre. En 2007, la maladie fait son apparition en Europe, où un des moustiques vecteurs, Aedes albopictus, s’est établi. Vers la fin de 2013 et en 2014, le Chikungunya s’est propagé aux Antilles et a atteint le continent américain. En 2014, 197 cas acquis aux États-Unis ont été rapportés, principalement dans l’état de Porto Rico.
Au Québec, tous les cas sont survenus chez des voyageurs revenant de pays où le virus Chikungunya est en circulation. En 2014, année où il y avait plusieurs pays en éclosion de Chikungunya en Amérique, on a diagnostiqué plus de 60 cas d’infections chez des Québécois au retour de voyage. Ce nombre a toutefois diminué depuis. En 2024, 26 québécois auraient contracté ce virus, et 25 en 2023. Le dernier cas concernant un résident de Chaudière-Appalaches daterait de 2020.
Le virus est principalement transmis par les piqûres de moustiques du genre Aedes, tout comme le virus de la dengue, le virus de la fièvre jaune et le virus Zika.
Modes de transmission | Manifestations cliniques | Période d’incubation | Personnes à risque de maladie sévère | |
Fréquentes | Rares | |||
|
| Formes sévères :
| 1 à 12 jours |
|